
(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为___.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是___.

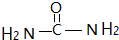
杂化,因为配体中配位原子提供孤对电子,所以尿素作配体时能作为配位原子的是O、N,故答案为:sp
(3)NH4NO3中阴离子为硝酸根离子,其中价层电子对个数=σ键个数+孤电子对个数=3,且不含孤电子对,所以硝酸根离子为平面三角形;根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,NO3-离子中有四个原子,价电子数为24,所以与NO3-离子互为等电子体的一种离子为CO32-等,故答案为:平面三角形,CO32-;
(4)1个硅氧四面体为SiO44-,则3个硅氧四面体彼此用3个角氧相连,即形成的Si3O96-离子;n个硅氧四面体彼此用四个角氧连接后形成空间网状结构的晶体,是通过Si-O共价键结合形成是二氧化硅,故答案为:Si3O96-;SiO2.
_吃瓜网最新官网入口">![氮化硅是一种新型无机非金属材料主要有α-氮化硅和β-两种晶型它们都是由[SiN4]正四面体共用顶角原子构成的三维空间网络结构β的结构如图所示:用甘氨酸(H2NCH2COOH)—晶胞图高清_产品中心_黑暗爆料 免费视频观看 - 吃瓜网最新官网入口|吃瓜每日更新热门事件|51精品㊙️入口黑料|吃瓜大合集](/sf/static/picture/banner-2.png)
(1)1mol甘氨酸分子中含有σ键的数目为___,组成该物质的各元素第一电离能由小到大的顺序为___.
(3)NH4NO3中阴离子的空间构型为___,由第1、2周期元素能成的与该阴离子互为等电子体的离子是___.
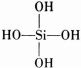
(原硅酸根)为硅氧四面体结构,顶角上的4个氧原子称作“角氧”.3个硅氧四面体彼此用3个角氧相连后,形成离子的化学式为___.n个硅氧四面体彼此用4个角氧连接后形成的物质的化学式是___.

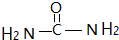
杂化,因为配体中配位原子提供孤对电子,所以尿素作配体时能作为配位原子的是O、N,故答案为:sp
(3)NH4NO3中阴离子为硝酸根离子,其中价层电子对个数=σ键个数+孤电子对个数=3,且不含孤电子对,所以硝酸根离子为平面三角形;根据等电子体概念可知,原子数和价电子数都相等的微粒互为等电子体,NO3-离子中有四个原子,价电子数为24,所以与NO3-离子互为等电子体的一种离子为CO32-等,故答案为:平面三角形,CO32-;
(4)1个硅氧四面体为SiO44-,则3个硅氧四面体彼此用3个角氧相连,即形成的Si3O96-离子;n个硅氧四面体彼此用四个角氧连接后形成空间网状结构的晶体,是通过Si-O共价键结合形成是二氧化硅,故答案为:Si3O96-;SiO2.